2025年11月11日,国家药品监督管理局医疗器械技术审评中心(CMDE)正式发布《可穿戴体外自动除颤设备临床试验注册审查指导原则(征求意见稿)》,旨在进一步规范并指导可穿戴体外自动除颤设备(Wearable Cardioverter Defibrillator, WCD)的临床试验设计与注册申报工作。
该文件的出台,标志着我国在可穿戴心脏急救设备领域的监管与标准化建设迈出关键一步,也为相关企业的产品研发与临床评价提供了明确方向。
什么是WCD? 可穿戴式心脏复律除颤器(WCD)是一种可自动检测并应对室性心动过速、心室颤动等危险心律的非侵入性体外设备。它主要用于心脏骤停(SCA)高风险患者的临时防护,能够在关键时刻实施电击复律,有效预防心脏性猝死,为患者提供持续、可移动的生命安全保障。
征求意见稿的适用范围
本指导原则适用于可穿戴体外自动除颤设备(WCD),产品分类编码为08-03-01,管理类别为第三类医疗器械。产品组成分为或可穿戴部分(包括:电极、电池、报警模块、监视部件、服装等)和不可穿戴部分(包括:充电器、调制解调器、测试仪、电脑等 )
适用人群:
有心脏骤停风险、不适合或拒绝植入ICD的成年患者
通常由医生处方,建议穿戴时间为2–3个月
不适用情形:
临床试验两大核心部分
1. 除颤心律识别准确性试验
目的:评估设备对室颤/室性心动过速的识别准确性,包括误报警率、漏报警率等。
设计:以第三方专家组(多位资深临床医师组成)评阅心电数据作为“金标准”,评估软件对于危及生命的室颤或室性心动过速检测结果的诊断准确度是否达到各项主要评价指标预期的目标值。
研究对象:建议使用已植入ICD/EV-ICD/S-ICD的患者,覆盖不同年龄、皮肤状态、活动状态。
评价指标:
注意:因该试验需基于申报产品的心电采集方式,一般需前瞻性的基于定义在明确入选和排除标准的基础上连续入组受试者。
主要指标:30天内误报警率、漏报警率
次要指标:真阳性检测、穿戴依从性、不良事件等
样本量建议:不低于130例
评价指标:
主要指标:30天内误报警率、漏报警率
次要指标:真阳性检测、穿戴依从性、不良事件等
注意:因该试验需基于申报产品的心电采集方式,一般需前瞻性的基于定义在明确入选和排除标准的基础上连续入组受试者。
2. 室性心律失常转复临床试验
提供两种试验设计思路:
(1)术中诱发试验
目的:验证申报产品用于心搏骤停(SCA)高风险人群室性心律失常转复治疗的安全有效性。试验可采用单组目标值设计。
对象:计划接受电生理相关手术,术中需诱发室性心律失常的成年患者,例如:
主要指标:使用试验装置成功进行心律转复(第一次或第二次除颤)的受试者人数与试验装置在相应数据集中尝试电击的总诱发次数的比值。
成功的心律转复定义为:通过从试验装置第一次或第二次除颤,将诱发的室性心律(>150次/min)终止为不可除颤复律的心律。
次要指标:室速或室颤第一次除颤的转复有效率 。
安全性指标:相关的不良事件
样本量建议:不低于20例
随访:术后2个月、术后出院前等。
(2)心脏骤停高危患者试验
目的:验证申报产品用于SCA危险的高风险人群中,申报产品室性心律失常转复治疗的安全有效性。试验可采用单组目标值设计。
对象:SCA高风险,既往接受ICD治疗但已移除或不适合植入ICD以及拒绝植入ICD的成人受试者。
主要指标:90天除颤成功率
次要指标:
(1)90天全因死亡率;
(2)90天心律失常死亡率;
(3)适当电击率(例/受试者日);
(4)首次电击成功率;
(5)总体电击成功率;
(6)受试器械每日平均穿戴时间(小时/天);
(7)受试器械平均使用天数(天)。
安全性指标:
(1)不适当电击率(例/受试者日),受试器械因非VT/ VF原因发放电击总例次/受试器械累积使用时间(日);
(2)误报警率(例/受试者日),受试器械因非VT/VF 原因发出警报例次/受试器械累积使用时间(日);
(3)不良事件发生率(例/受试者日);
(4)器械缺陷;
(5)器械故障发生率(例/受试者日)
随访时间:≥3个月
样本量建议:未明确具体数量,但需保证足够事件数
国内外品牌及临床研究
1、Life Vest WCD可穿戴式除颤器
早在2014年,ZOLL第4代WCD 产品 (Life Vest 4000)获得 FDA批准。由于 WCD 对除颤算法、传感器精密性具有极高要求,LifeVest®是最早应用于临床的WCD,具有较多的临床应用数据,在临床上展示了安全性、可行性及特定情况下的有效性。
VEST临床试验采用多中心、开放性、随机对照试验,纳入2302名发生MI后LVEF≤35%且住院时间小于7天的患者,按2:1的比例接受药物治疗+WCD和单独药物治疗。主要终点:心梗后三个月内猝死,次要终点由全因死亡、特殊原因死亡、非致死性室性心律失常和住院共同组成。
在VEST试验中,器械组1,524例患者中的20例(1.3%)接受了适当的电击。其中13例患者接受了1次适当电击,7例患者接受了2次或2次以上适当电击。在暂停电击方面,1524例患者中有69例(4.5%)通过按压反应按钮终止1次或多次电击。受试者与研究者并非双盲,组间存在交叉,20名对照组患者接受了WCD,19%的WCD组患者并未使用WCD

研究结果:
两组患者猝死和室性心动过速所致死亡的发生率无显著差异(WCD组1.6% vs 对照组 2.4%,P=0.18)。
全因死亡率却存在差异(WCD组3.1% vs 对照组 4.9%,P=0.04)。
对所有致死事件分别进行分析发现对照组卒中所致死亡率明显较高(WCD组 0.0% vs 对照组 0.5%,P=0.01)。
分析表明:在心肌梗死后的头3个月内,遵医嘱使用WCD的射血分数≤35%的患者具有保护作用。
2、ASSURE WCD可穿戴式除颤器
2021年8月,FDA 批准了 Kestra Medical的 ASSURE WCD 系统,采信了130+13例的两组临床结果,但获批后还需要在 24个月内补充 5000 多例人组患者。
ASSURE WCD临床试验设计采用多中心前瞻性非随机研究。共纳入130名有活动性植入式心脏复律除颤器(ICD)且左心室射血分数(LVEF)≤40%的患者。患者穿戴ASSURE WCD 30天。在ACE-CONVERT研究中,ASSURE除颤波形在终止VF方面的有效性为100%。
ASSURE WCD 真实世界研究:Kestra Medical Technologies 于2025年11月11日公布了其可穿戴心律转复除颤器批准后研究的主要结果。该研究在美国招募了 21,612 名患者。关键研究结果表明了该设备在真实世界使用中具有一致的安全性、有效性和依从性。包括对室性心动过速心室颤动事件的转复成功率达到 100%。这超过了预设的性能目标,达到了主要有效性终点。该研究也达到了其主要安全性终点,观察到的不恰当电击率为每患者月 0.0065 次。该数值低于预设的性能目标,证实了其强大的安全性。
Kestra Medical的旗舰产品ASSURE (WCD) 是一款创新的可穿戴式心脏复律除颤器,专为暂时不适合植入式心脏除颤器(ICD)但仍面临心脏骤停风险的患者设计。
据公开信息报道,2024年2月14日,Kestra Medical 提交了一份S-1表格,确认其计划通过首次公开募股(IPO)上市,并且设定了筹集约1亿美元的目标。2024年7月,Kestra Medical Technologies宣布完成了一轮1.96亿美元(合约14.21亿人民币)的超额认购融资。这笔资金将用于加速Kestra Medical旗下产品ASSURE® WCD的商业化进程,并进一步推动公司在可穿戴医疗设备领域的市场扩张。

3、Jewel Patch-WCD可穿戴式除颤器
2025年5月,美国食品药品监督管理局(FDA)正式批准了Element Science公司开发的Jewel Patch-WCD宝石贴片可穿戴式心脏转复除颤器。Jewel Patch-WCD的设计深刻理解患者需求,它将以人为本的设计原则与机器学习的最新进展相结合。具备防水功能,可在淋浴时提供持续保护,且外形小巧隐蔽,使患者能够随心所欲地生活,摆脱传统设备的束缚。其复杂的算法和人性化的设计使其成为患者可信赖的守护者,患者可在家中舒适地使用,并在日常活动中防止心脏骤停。
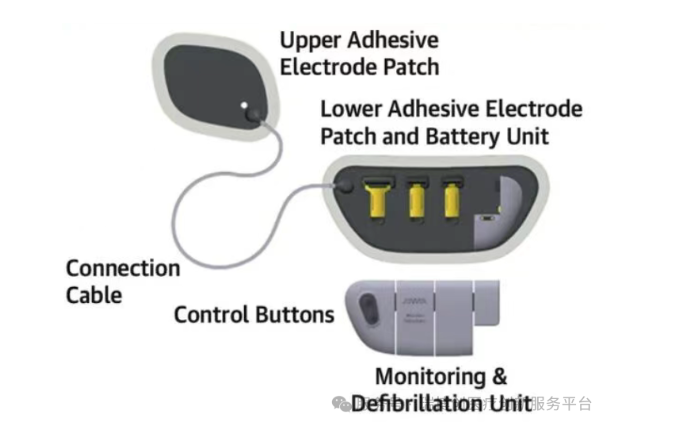
Jewel Patch-WCD临床试验采用前瞻性、单臂研究,在美国30个研究中心进行,纳入了因室性心动过速/心室颤动而有SCD风险的患者。主要安全终点: <15%的患者出现临床显著的皮肤不良反应。主要有效性终点: <2次不当电击/100患者月。次要终点: 至少1次成功的室性心动过速/心室颤动转换和每天>14.1小时的穿戴时间依从性。研究结果显示,新型P-WCD是一种安全、有效的WCD,患者依从性高,没有死亡,且电击复律成功率高。
4、PowerBeat V3®可穿戴式除颤器(WCD)
PowerBeat V3® 是由苏州维伟思医疗科技有限公司自主研发的可穿戴式除颤器(WCD)。该公司成立于2019年,是一家专注于室性心律失常防治与心律数据服务的高科技创新企业。
PowerBeat V3®产品融合多项核心技术,包括:双相截断指数波除颤技术;高效的VF/VT心律识别算法;基于人工智能的心电数据分析系统。
PowerBeat V3® 专为患者在院外环境中长时程、连续穿戴使用而设计,能够实现全自动的室颤/室速识别与分析,并在必要时实施全自动除颤治疗,为高风险患者提供持续、可靠的生命安全保障。
维伟思医疗在资本层面亦获得持续支持:
在充足的资金保障下,公司已开发出包括固定式AED、便携式AED、无人机AED及智慧物联管理系统等在内的多款创新产品。其中,无人机AED 突破了传统设备的部署限制,通过“无人机 + AED”的创新融合,为心脏骤停的远程应急响应构建了全新的救援场景,极具行业前瞻性与社会价值。

结语
AED产品技术已发展成熟,目前国内获批的数十款AED设备仍以传统形态为主。然而,随着可穿戴式心脏复律除颤器(WCD)的兴起,未来预计将有更多企业投身于该领域的研发。
在市场竞争加剧与融资环境趋冷的背景下,苏州维伟思公司凭借其自主研发的AED创新产品,成功获得多轮资本支持,为行业带来重要启示:具备前沿技术、核心发明专利,并能真正服务于临床需求的产品,从来不会缺少资本的认可。相反,盲目跟风与简单模仿,只能被动追随技术浪潮,最终在红海竞争中陷入困境。
在可穿戴式心脏复律除颤器WCD产品的技术应用方面,其场景也将呈现多样化趋势。例如,可在WCD弹性背心中集成温度、压力、声学、光学等先进传感器,实现体温、血氧、心音、肺电阻抗、连续血压等生理参数的无扰式动态监测,并将数据反馈至治疗方案中,从而实现智能化监护与精准除颤的一体化融合。
技术创新不止步,应用场景不受限,WCD不仅是对传统除颤设备的形态突破,更是构建未来智能心律管理生态的关键一环。如果您也看中这一市场,欢迎与我们沟通交流,瑞博创可以全流程助您产品市场准入。
--END--